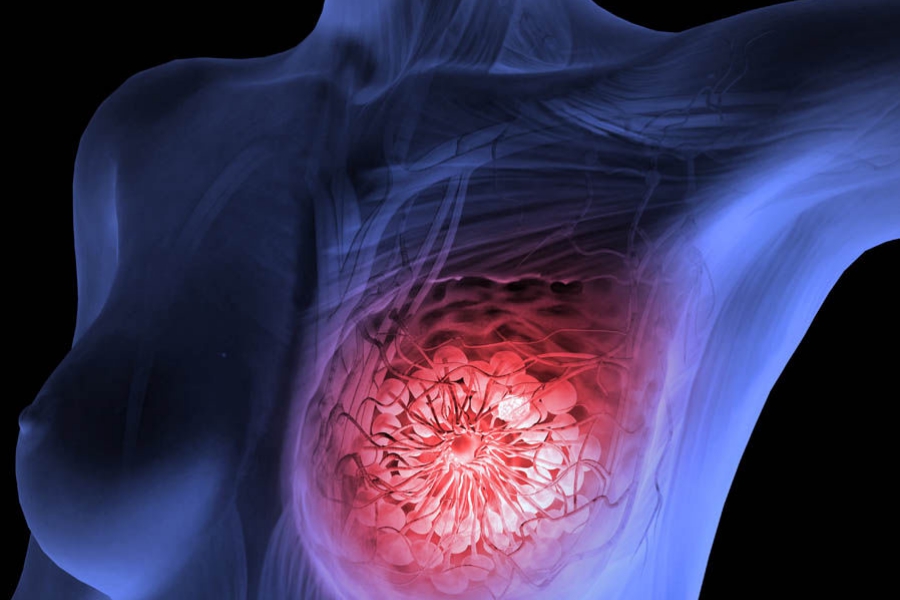
Ο Ευρωπαϊκός Οργανισμός Φαρμάκων (EMA) ενέκρινε πρόσφατα τη χορήγηση άδειας κυκλοφορίας στην Ευρωπαϊκή Ένωση (ΕΕ) στο πρώτο σκεύασμα μίας νέας κατηγορίας φαρμάκων, το οποίο αφορά τη θεραπεία μίας επιθετικής μορφής καρκίνου του μαστού: του τριπλά αρνητικού καρκίνου του μαστού.
Πρόκειται για το σκεύασμα Trodelvy (sacituzumab govitecan), το οποίο αφορά τη θεραπεία ενηλίκων ασθενών με ανεγχείρητο (δεν μπορεί να αφαιρεθεί με χειρουργική επέμβαση) ή μεταστατικό τριπλά αρνητικό καρκίνο του μαστού, που έχουν λάβει δύο ή περισσότερες θεραπείες και τουλάχιστον μία από αυτές για προχωρημένη νόσο. Ο τριπλά αρνητικός καρκίνος του μαστού είναι ένας επιθετικός τύπος καρκίνου του μαστού που δεν έχει τους συνήθεις υποδοχείς (στόχους), στους οποίους δρουν άλλα στοχευμένα αντικαρκινικά φάρμακα.
Επί του παρόντος, η χημειοθεραπεία παραμένει η τυπική θεραπεία για ασθενείς με μεταστατικό τριπλά αρνητικό καρκίνο του μαστού. Ωστόσο, υπολογίζεται ότι μόνο το 10 έως 15% των ασθενών με αυτόν τον τύπο καρκίνου ανταποκρίνεται σε αυτή τη θεραπεία και ο χρόνος χωρίς επιδείνωση της νόσου τους είναι μόλις 2 έως 3 μήνες. Ως εκ τούτου, υπάρχει μεγάλη ανεκπλήρωτη ιατρική ανάγκη για νέες θεραπείες που βελτιώνουν τις προοπτικές για τους ασθενείς.
Το δραστικό συστατικό του Trodelvy είναι η sacituzumab govitecan. Συνδυάζει ένα εξανθρωπισμένο αντίσωμα (ένας τύπος πρωτεΐνης) σχεδιασμένο να αναγνωρίζει και να προσκολλάται στον υποδοχέα Trop-2 με έναν τύπο αντινεοπλασματικού παράγοντα, που ονομάζεται αναστολέας τοποϊσομεράσης Ι. Αυτό έχει σκοπό να εμποδίσει την ανάπτυξη, τη διαίρεση και την εξάπλωση του καρκίνου.
Η επιτροπή ανθρώπινων φαρμάκων του EMA (CHMP) εξέτασε την αίτηση για άδεια κυκλοφορίας στο πλαίσιο ενός επιταχυνόμενου χρονοδιαγράμματος για να επιτρέψει την ταχύτερη πρόσβαση των ασθενών σε αυτό το φάρμακο. Η CHMP στήριξε τη σύστασή της σε δεδομένα από μια πολυκεντρική, ανοιχτή, τυχαιοποιημένη κλινική δοκιμή Φάσης 3. Η μελέτη διερεύνησε την ασφάλεια και την αποτελεσματικότητα του Trodelvy σε 529 ασθενείς με ανεγχείρητο, τοπικά προχωρημένο ή μεταστατικό τριπλά αρνητικό καρκίνο του μαστού (mTNBC).
Όλοι οι ασθενείς που εγγράφηκαν είχαν υποτροπιάσει μετά από τουλάχιστον δύο προηγούμενες χημειοθεραπείες για καρκίνο του μαστού. Οι συμμετέχοντες τυχαιοποιήθηκαν (1:1) για να λάβουν sacituzumab govitecan 10 mg/kg ως ενδοφλέβια έγχυση τις ημέρες 1 και 8 ενός κύκλου 21 ημερών ή θεραπείας της επιλογής του γιατρού (eribulin, vinorelbine, gemcitabine ή capecitabine).
Το φάρμακο παρέτεινε τη συνολική επιβίωση (δηλαδή πόσο καιρό ζουν οι ασθενείς) κατά περίπου 5 μήνες (11,8 μήνες για τη sacituzumab govitecan σε σύγκριση με 6,9 μήνες για τη θεραπεία της επιλογής του γιατρού) και την επιβίωση χωρίς εξέλιξη (δηλαδή πόσο καιρό ζουν οι ασθενείς χωρίς να επιδεινώνεται η νόσος τους ) κατά περίπου 3 μήνες (4,8 μήνες για τη sacituzumab govitecan σε σύγκριση με 1,7 μήνες για τη θεραπεία της επιλογής του γιατρού).
Οι πιο συχνές ανεπιθύμητες ενέργειες του Trodelvy σε κλινικές δοκιμές περιελάμβαναν διάρροια, ναυτία, ουδετεροπενία, κόπωση, αλωπεκία, αναιμία, έμετο, δυσκοιλιότητα, μειωμένη όρεξη, βήχα και κοιλιακό άλγος.
















Comments (0)