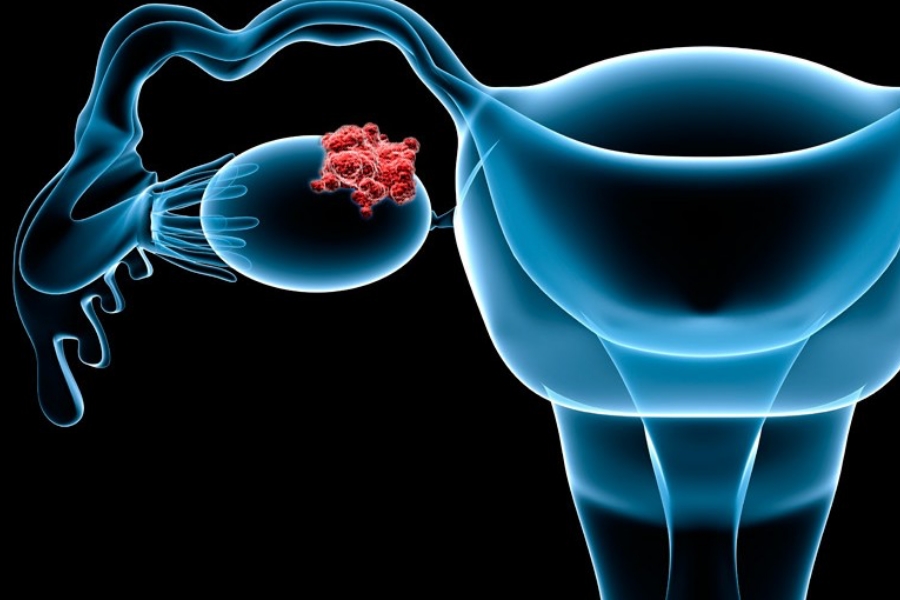
Η στοχευμένη θεραπεία Lynparza (olaparib) έλαβε δύο νέες εγκρίσεις στην Ευρωπαϊκή Ένωση. Η πρώτη είναι για τη θεραπεία συντήρησης πρώτης γραμμής, παράλληλα με το bevacizumab, σε ασθενείς με προχωρημένο καρκίνο των ωοθηκών και η δεύτερη αφορά ασθενείς με μεταστατικό καρκίνο του προστάτη.
Η πρώτη έγκριση βασίστηκε στα αποτελέσματα της δοκιμής φάσης III με την ονομασία PAOLA-1, στην οποία το Lynparza βελτίωσε σημαντικά το μέσο χρονικό διάστημα, που οι ασθενείς ζούσαν χωρίς εξέλιξη της νόσου κατά περισσότερο από 3 χρόνια σε σύγκριση με το bevacizumab μόνο.
“Για γυναίκες με προχωρημένο καρκίνο των ωοθηκών, ο στόχος της θεραπείας πρώτης γραμμής είναι να καθυστερήσει την εξέλιξη της νόσου για όσο το δυνατόν περισσότερο με την πρόθεση να επιτευχθεί μακροχρόνια ύφεση. Δυστυχώς, μόλις υποστεί υποτροπή τότε η νόσος είναι ανίατη”, δήλωσε η ογκολόγος Isabelle Ray-Coquard, κύρια ερευνήτρια της μελέτης και πρόεδρος της ομάδας GINECO στη Γαλλία. “Το Lynparza μαζί με το bevacizumab έχει δείξει ένα εντυπωσιακό μέσο όρο επιβίωσης χωρίς πρόοδο της νόσου για περισσότερα από τρία χρόνια και είναι έτοιμο να γίνει το επίπεδο φροντίδας για επιλέξιμους ασθενείς με θετικούς σε HRD όγκους στην Ε.Ε.”, πρόσθεσε.
Η δεύτερη έγκριση βασίστηκε στα αποτελέσματα της μελέτης PROfound,, στην οποία το Lynparza βελτίωσε το χρονικό διάστημα επιβίωσης χωρίς πρόοδο της νόσου έναντι της ενζουλουταμίδης ή της αβιρατερόνης και μείωσε τον κίνδυνο εξέλιξης της νόσου ή θανάτου κατά 78%. Η μέση συνολική επιβίωση ήταν 20,1 μήνες έναντι 14,4 μήνες για ασθενείς με μεταστατικό ευνουχοάντοχο καρκίνο προστάτη (mCRPC) με μεταλλάξεις BRCA 1/2.






















Comments (0)