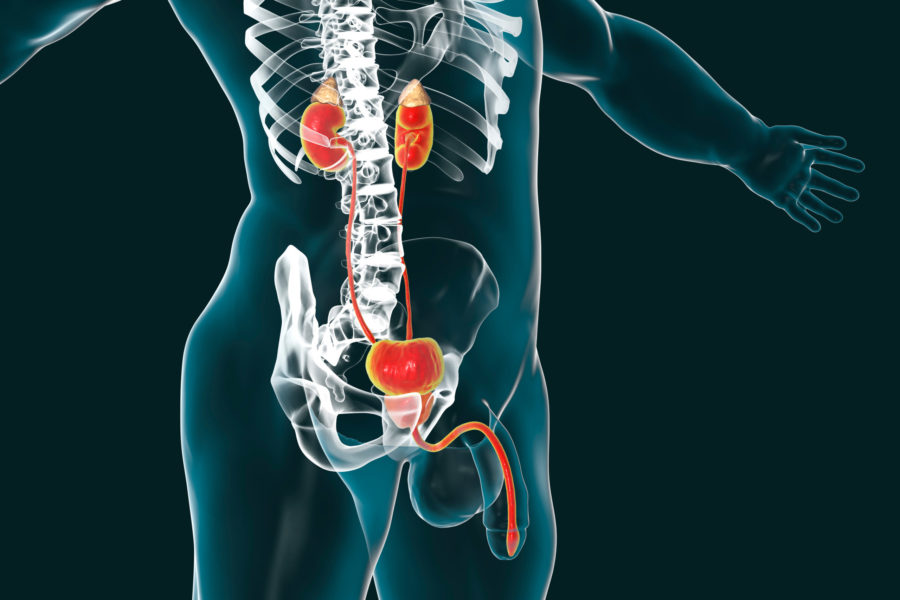
Το «πράσινο φως» έδωσε η Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση (CHMP) του Ευρωπαϊκού Οργανισμού Φαρμάκων (ΕΜΑ) σχετικά με τη χορήγηση άδειας κυκλοφορίας στην Ε.Ε. της δαρολουταμίδης σε άνδρες με μη μεταστατικό, ευνουχοάντοχο καρκίνο του προστάτη.
Ωστόσο, η τελική απόφαση του ΕΜΑ σχετικά με την άδεια κυκλοφορίας αναμένεται τους επόμενους μήνες.
Πρόκειται για έναν αναστολέα μη στεροειδικών υποδοχέων ανδρογόνων (ARi) που χορηγείται σε άνδρες με μη μεταστατικό, ευνουχοάντοχο καρκίνο του προστάτη (nmCRPC), οι οποίοι όμως διατρέχουν υψηλό κίνδυνο ανάπτυξης μεταστατικής νόσου.
Ο αναστολέας των υποδοχέων ανδρογόνου (ARi) έχει ήδη εγκριθεί στις ΗΠΑ, τη Βραζιλία και την Ιαπωνία, ενώ η διαδικασία έγκρισής του και σε άλλες χώρες, βρίσκεται σε εξέλιξη.
Αξίζει να σημειωθεί ότι το νέο σκεύασμα αναπτύσσεται από κοινού από την Bayer και την Φιλανδική Orion Corporation.
Σημειώνεται ότι η εν λόγω μορφή καρκίνου του προστάτη περιορίζεται στην συγκειμένη περιοχή και αντιμετωπίζεται με αντιανδρογόνα. Παρ’ όλα αυτά, συνεχίζει να αναπτύσσεται, ακόμη και όταν η ποσότητα της τεστοστερόνης μειωθεί στον οργανισμό του ασθενούς.
Σε ευρωπαϊκό επίπεδο υπολογίζεται ότι περισσότεροι από 67.000 άνδρες πάσχουν από ευνουχοάντοχο καρκίνο του προστάτη.
Κατόπιν της τελικής έγκρισης η Bayer θα προωθήσει το σκεύασμα σε ορισμένες ευρωπαϊκές αγορές, π.χ. στη Γαλλία, τη Γερμανία, την Ιταλία, την Ισπανία, το Ηνωμένο Βασίλειο, τη Σκανδιναβία και τη Φινλανδία.
Η μελέτη
Για τη θετική γνωμάτευση της CHMP ελήφθησαν υπόψιν αποτελέσματα της μελέτης ARAMIS, μιας μελέτης Φάσης ΙΙΙ που αξιολόγησε τη συνδυαστική θεραπεία δαρολουταμίδης και αντιανδρογόνου (ADT) σε σύγκριση με το εικονικό φάρμακο συν ADT.
Συγκεκριμένα, καταδείχθηκε σημαντική βελτίωση στο πρωτεύον τελικό σημείο αποτελεσματικότητας, το οποίο ήταν το διάστημα επιβίωσης ελεύθερο μεταστάσεων με μέση τιμή 40,4 μηνών για το συνδυασμό δαρολουταμίδης και αντιανδρογόνου, έναντι 18,4 μηνών για το εικονικό φάρμακο συν ADT. Επίσης, σύμφωνα με την μελέτη ο συνδυασμός διαθέτει ευνοϊκό προφίλ ασφάλειας.
Τη διέξοδο που προσφέρεται σε ασθενείς με μη μεταστατικό ευνουχοάντοχο καρκίνο του προστάτη, οι οποίοι συνήθως έχουν ασυμπτωματική νόσο, επεσήμανε ο Αντιπρόεδρος και Διευθυντής Ανάπτυξης του Τμήματος Ογκολογίας της Bayer AG Dr. Scott Z. Fields.
Στα θετικά σημεία εστίασε ο κ. Dr. Scott Z. Fields όπως είναι η επέκταση του διαστήματος επιβίωσης απουσία μεταστάσεων στο nmCRPC, καθώς και στον περιορισμό του αντίκτυπου των ανεπιθύμητων ενεργειών.
Την πρόοδο που σημειώνεται με τη θετική γνωμοδότηση της CHMP καθώς και την αφοσίωση στην παροχή καινοτόμων φαρμάκων τόνισε ο Αντιπρόεδρος Εμπορικών Δραστηριοτήτων της Orion Corporation, Satu Ahomäki. Μάλιστα, ο ίδιος δήλωσε σχετικά «Ανυπομονούμε για τη συν-προώθηση με τη Bayer, ώστε να παρέχουμε την καλύτερη δυνατή υποστήριξη στους ασθενείς με καρκίνο του προστάτη, αλλά και στους επαγγελματίες υγείας».




















Comments (0)