Η επιτροπή του FDA υπερψήφισε με 15 ψήφους υπέρ και 0 κατά για την ανάπτυξη ενός νέου φαρμάκου σε ασθενείς με ηπατίτιδα C, ανοίγοντας το δρόμο σε μια νέα θεραπεία πιο αποτελεσματική σε σχέση με τις υπάρχουσες.
Εάν εγκριθεί, θα αποτελέσει την πρώτη θεραπεία δια στόματος για γονότυπους 2 και 3, καταργώντας την αναγκαία έως τώρα ενέσιμη ιντερφερόνη, η οποία μπορεί να προκαλέσει σοβαρές παρενέργειες.
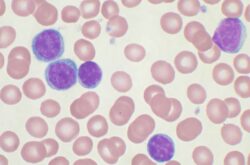
Ταυτόχρονα, η επιτροπή ψήφισε επίσης ομόφωνα για την έγκριση του φαρμάκου σε ασθενείς με παραλλαγές σε γονότυπο 1 και γονότυπο 4, σε συνδυασμό με ριμπαβιρίνη και ιντερφερόνη, για ασθενείς που δεν έχουν λάβει προηγούμενη θεραπεία. Ο γονότυπος 1 αντιπροσωπεύει περίπου το 70% των κρουσμάτων ηπατίτιδας C. Ενώ, η χρόνια ηπατίτιδα C επηρεάζει τουλάχιστον 3 εκατ. ανθρώπους στις Ηνωμένες Πολιτείες, σύμφωνα με το Αμερικανικό Κέντρο Ελέγχου και Πρόληψης Νοσημάτων.
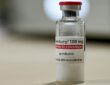
Πάντως, μέλη της επιτροπής, υποστηρίζουν τη χρήση του sofosbuvir σε ασθενείς που δεν ανταποκρίθηκαν σε προηγούμενη θεραπεία, παρόλο που η εταιρεία δεν έχει στοιχειοθετήσει πλήρως το ζήτημα. Η Gilead απέκτησε το sofosbuvir, που είναι γνωστό και ως νουκλεοτίδιο ανάλογο αναστολέα, έναντι 11 εκατ. δολ., με την εξαγορά της Pharmasset Inc το 2012.

Gilead: Θετική γνωμοδότηση για θεραπεία ηπατίτιδας C
Σχετικά άρθρα
Περιοδικό Pharma & Health Business

Δημοφιλή
 Ποιος είναι ο Εμμανουήλ Φανδρίδης ο χειρουργός που ανέλαβε την επέμβαση της Μαρέβας Μητσοτάκη
Ποιος είναι ο Εμμανουήλ Φανδρίδης ο χειρουργός που ανέλαβε την επέμβαση της Μαρέβας Μητσοτάκη  Ξεκίνησε η υποβολή αιτήσεων για την Προκήρυξη 1Κ/2026 – 510 μόνιμες θέσεις στο Υπουργείο Υγείας
Ξεκίνησε η υποβολή αιτήσεων για την Προκήρυξη 1Κ/2026 – 510 μόνιμες θέσεις στο Υπουργείο Υγείας  Mε 160 αιτήματα η πρώτη ημέρα για τη διανομή Φαρμάκων Υψηλού Κόστους και από τα ιδιωτικά φαρμακεία
Mε 160 αιτήματα η πρώτη ημέρα για τη διανομή Φαρμάκων Υψηλού Κόστους και από τα ιδιωτικά φαρμακεία  Κατεπείγουσα ΕΔΕ για τον θάνατο ασθενούς στο Κέντρο Υγείας Σαλαμίνας
Κατεπείγουσα ΕΔΕ για τον θάνατο ασθενούς στο Κέντρο Υγείας Σαλαμίνας  Διανομή ΦΥΚ από τα φαρμακεία της γειτονιάς: Τι πρέπει να γνωρίζουν οι πολίτες
Διανομή ΦΥΚ από τα φαρμακεία της γειτονιάς: Τι πρέπει να γνωρίζουν οι πολίτες  Παράταση για τους 4.000 εργαζόμενους στο ΕΣΥ με πρόγραμμα της ΔΥΠΑ
Παράταση για τους 4.000 εργαζόμενους στο ΕΣΥ με πρόγραμμα της ΔΥΠΑ











Comments (0)