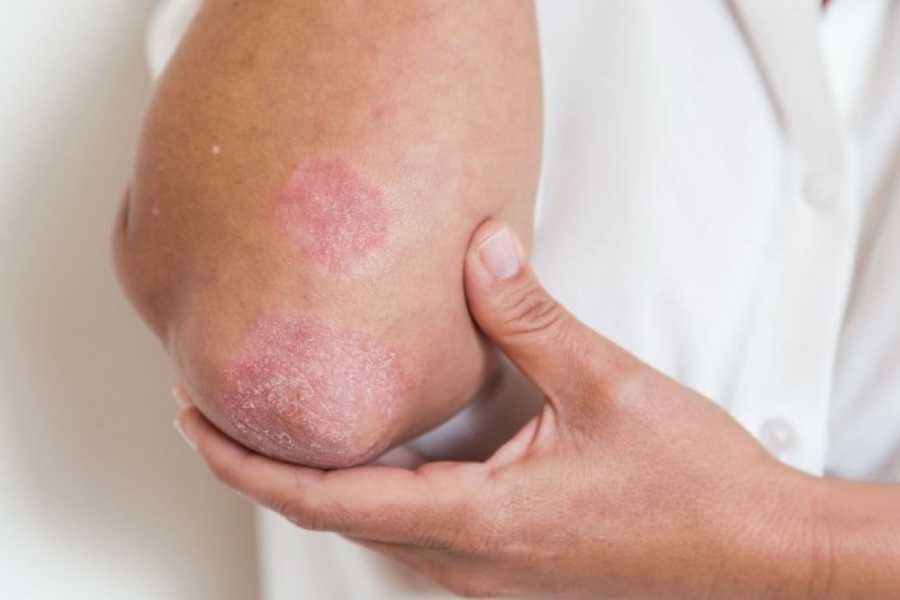
Η βελγική φαρμακευτική εταιρεία UCB ανακοίνωσε ότι δημοσιεύτηκαν στο περιοδικό New England Journal of Medicine τα πλήρη αποτελέσματα δύο μεγάλων μελετών, που αφορά την υπό ανάπτυξη φαρμακευτική ουσία Bimekizumab. Βρέθηκε ότι η νέα ουσία μπορεί να βοηθήσει αποτελεσματικά ασθενείς που πάσχουν από μέτρια ως σοβαρή μορφή της νόσου.
Ειδικότερα, πρόκειται για τις μελέτες BΕ RADIANT και BE SURE, που συνέκριναν την ασφάλεια και αποτελεσματικότητα του bimekizumab με δύο ήδη εγκεκριμένες θεραπείες κατά της νόσου, το secukinumab και το adalimumab αντίστοιχα.
- H BE RADIANT είναι η πρώτη μελέτη φάσης 3 που συνέκρινε την αποτελεσματικότητα και την ασφάλεια της διπλής αναστολής των IL-17A και IL-17F, έναντι της αναστολής της IL-17A μόνο. Η μελέτη πέτυχε το κύριο καταληκτικό της σημείο, με σημαντικά περισσότερους ασθενείς που έλαβαν bimekizumab, να επιτυγχάνουν πλήρη κάθαρση δέρματος, τη 16η εβδομάδα σε σύγκριση με τους ασθενείς, που έλαβαν secukinumab (61,7% έναντι 48,9% αντιστοίχως, p<0,001).Καθ’ όλη τη διάρκεια της μελέτης, το πιο κοινό ανεπιθύμητο σύμβαμα που προέκυψε από τη θεραπεία (TEAEs) με bimekizumab ήταν η λοίμωξη ανώτερου αναπνευστικού (38.9%), στοματική λοίμωξη από candida(19.3%) και λοιμώξεις ουροποιητικού (6.7%). Οι λοιμώξεις του ανώτερου αναπνευστικού συστήματος περιλαμβάνουν λαρυγγίτιδα, ρινοφαρυγγίτιδα, φαρυγγικό απόστημα, φαρυγγίτιδα, ρινίτιδα, ιγμορίτιδα, αμυγδαλίτιδα και λοίμωξη του ανώτερου αναπνευστικού συστήματος. Τα περιστατικά στοματικής καντιντίασης ήταν κυρίως ήπιας ή μέτριας βαρύτητας και κανένα δεν οδήγησε σε διακοπή της θεραπείας. Σε διάστημα 48 εβδομάδων η επίπτωση των σχετιζόμενων με τη θεραπεία ανεπιθύμητων συμβάντων ήταν 5,9% για το bimekizumab και 5,7% με το secukinumab .
- Η BE SURE πέτυχε τα κύρια καταληκτικά σημεία της, αποδεικνύοντας ότι οι ασθενείς που έλαβαν bimekizumab πέτυχαν ανώτερα επίπεδα κάθαρσης του δέρματος, την 16η εβδομάδα, σε σύγκριση με εκείνους που έλαβαν adalimumab. Το προφίλ ασφάλειας του bimekizumab ήταν συνεπές με τα αποτελέσματα των προηγούμενων κλινικών μελετών και δεν εντοπίστηκαν νέα σήματα ασφάλειας.
Τον Σεπτέμβριο του 2020, η UCB ανακοίνωσε ότι τόσο ο αμερικανικός (FDA) όσο και ο ευρωπαϊκός οργανισμός φαρμάκων (EMA) είχαν αποδεχτεί την Αίτηση Βιολογικής Άδειας της Εταιρείας (BLA) και την Αίτηση Άδειας Κυκλοφορίας (MAA), αντίστοιχα, για το bimekizumab για τη θεραπεία της μέτριας έως σοβαρής Ψωρίασης κατά Πλάκας σε ενήλικες ασθενείς.




















Comments (0)