Η ελβετική φαρμακοβιομηχανία Novartis έκανε γνωστό ότι κατέθεσε αίτηση σε ΗΠΑ και Ε.Ε. για την έγκριση ενός νέου φαρμάκου για τη δευτεροπαθώς προϊούσα πολλαπλή σκλήρυνση.
Αυτή η μορφή της νόσου χαρακτηρίζεται από συνεχή επιδείνωση της νευρολογικής λειτουργίας με την πάροδο του χρόνου, ανεξάρτητα από υποτροπές. Οι περισσότεροι άνθρωποι με υποτροπιάζουσα σκλήρυνση θα προχωρήσουν τελικά στην ανάπτυξη αυτής της μορφής.
Περίπου το 85% των ατόμων με πολλαπλή σκλήρυνση διαγιγνώσκεται αρχικά με υποτροπιάζουσα-διαλείπουσα πολλαπλή σκλήρυνση. Χαρακτηρίζεται από επεισόδια υποτροπών, τα οποία ακολουθούνται από διαστήματα πλήρης ύφεσης με ή χωρίς υπόλειμμα αναπηρίας. Η πλειοψηφία αυτών των ατόμων θα μεταπέσει τελικά σε δευτεροπαθώς προϊούσα πολλαπλή σκλήρυνση, όπου η αναπηρία εξελίσσεται σταδιακά και μεταξύ των υποτροπών.
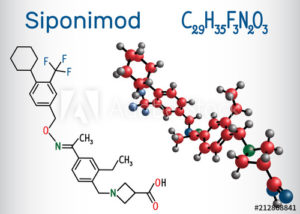 Το νέο φάρμακο με την ονομασία Siponimod είναι ένας εκλεκτικός τροποποιητής ειδικών τύπων του υποδοχέα της φωσφορικής σφιγγοσίνης-1 (S1P). Ο υποδοχέας αυτός εντοπίζεται συχνά στην επιφάνεια ειδικών κυττάρων, που βρίσκονται στο κεντρικό νευρικό σύστημα (ΚΝΣ) και ευθύνονται για την πρόκληση της βλάβης, που οδηγεί στην απώλεια της λειτουργικότητας στη δευτεροπαθώς προϊούσα μορφή της νόσου.
Το νέο φάρμακο με την ονομασία Siponimod είναι ένας εκλεκτικός τροποποιητής ειδικών τύπων του υποδοχέα της φωσφορικής σφιγγοσίνης-1 (S1P). Ο υποδοχέας αυτός εντοπίζεται συχνά στην επιφάνεια ειδικών κυττάρων, που βρίσκονται στο κεντρικό νευρικό σύστημα (ΚΝΣ) και ευθύνονται για την πρόκληση της βλάβης, που οδηγεί στην απώλεια της λειτουργικότητας στη δευτεροπαθώς προϊούσα μορφή της νόσου.
Το φάρμακο εισέρχεται στον εγκέφαλο και δεσμευόμενο σε αυτούς τους ειδικούς υποδοχείς μπορεί να αποτρέψει την ενεργοποίηση των επιβλαβών κυττάρων, βοηθώντας στη μείωση της απώλειας σωματικής και νοητικής λειτουργίας ,που σχετίζονται με τη δευτεροπαθώς προϊούσα μορφή της πολλαπλής σκλήρυνσης.
Οι αιτήσεις που υπέβαλλε η Novartis στις ρυθμιστικές αρχές ΗΠΑ και Ε.Ε. περιλαμβάνουν δεδομένα από τη μελέτη EXPAND, η οποία αποτελεί τη μεγαλύτερη, τυχαιοποιημένη μελέτη στη δευτεροπαθώς προϊούσα μορφή της νόσου μέχρι σήμερα. Το φάρμακο μείωσε:
- Κατά 21% τον κίνδυνο τριμηνίας επιβεβαιωμένης εξέλιξης της αναπηρίας.
- Κατά 26% τον κίνδυνο εξάμηνης επιβεβαίωσης της εξέλιξης της αναπηρίας.
- κατά 55% το ετήσιο ποσοστό υποτροπής έναντι του εικονικού φαρμάκου.
«Το Siponimod είναι το πρώτο ερευνητικό φάρμακο που δείχνει σημαντική καθυστέρηση στην πρόοδο της αναπηρίας σε ασθενείς με δευτεροπαθώς προϊούσα πολλαπλή σκλήρυνση», δήλωσε ο Paul Hudson, διευθύνων σύμβουλος της Novartis Pharmaceuticals. «Εργαζόμαστε στενά με το FDA και το EMA για να διασφαλίσουμε ότι θα είναι διαθέσιμο για τους ασθενείς το συντομότερο δυνατό».
Το επόμενο βήμα στην εγκριτική διαδικασία του φαρμάκου αναμένεται γύρω στο Μάρτιο του 2019 για τις ΗΠΑ, ενώ στην Ε.Ε. γύρω στα τέλη του 2019.
















Comments (0)