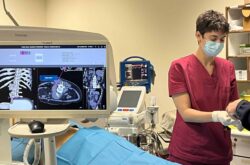
Το «πράσινο» φως έλαβε από την Ισπανική Αρχή Φαρμάκων(AEMPS) κλινική δοκιμή σε ανθρώπους του πρώτου ισπανικού εμβολίου έναντι της COVID-19. Πρόκειται για την κλινική δοκιμή του εμβολίου PHH-1V της εταιρείας Hipra.
Σύμφωνα με την EL Pais, η δοκιμή Φάσης 1 στοχεύει στην αξιολόγηση της ασφάλειας, της ανοχής, της ανοσογονικότητας (η ικανότητα πρόκλησης ανοσοαπόκρισης) και της αποτελεσματικότητας.Η δοκιμή θα συγκρίνει το υποψήφιο εμβόλιο PHH-1V με άλλα εμβόλια που έχουν εγκριθεί για χρήση σε ανθρώπους.
Τριάντα άτομα ηλικίας 18 έως 30 ετών αναμένεται να συμμετάσχουν σε αυτήν την πρώτη φάση. Το εμβόλιο θα δοκιμαστεί σε εθελοντές που δεν είχαν τον κορωνοϊό ούτε μία δόση εμβολίου Covid-19. Οι εθελοντές δεν θα γνωρίζουν επίσης εάν λαμβάνουν το εμβόλιο PHH-1V ή αν ανήκουν στην ομάδα ελέγχου, στην οποία θα δοθούν δύο δόσεις εξουσιοδοτημένου εμβολίου που χρησιμοποιεί τεχνολογία αγγελιοφόρου RNA, όπως το Pfizer-BioNTech, σε τρεις διάστημα της εβδομάδας.
Μια ανεξάρτητη επιτροπή θα παρακολουθεί τους εθελοντές για τυχόν δυσμενείς επιπτώσεις ή περιπτώσεις λοιμώξεων. Η δοκιμή αναμένεται να διαρκέσει μήνες, αλλά η AEMPS δεν έχει ορίσει συγκεκριμένο χρονικό πλαίσιο.
Πριν ακόμη την έκκριση για την κλινική δοκιμή, ο Toni Maneu, επικεφαλής της ανθρώπινης υγείας στο Hipra, επεσήμανε ότι από τα αποτελέσματα των προκλινικών δοκιμών (σε εργαστήρια και σε ζώα) προκύπτει πω; το εμβόλιο PHH-1V ήταν ακόμη αποτελεσματικό ενάντια στο πιο μεταδοτικό δέλτα στέλεχος, το οποίο είναι πλέον κυρίαρχο στην Ισπανία.
Η τενχολογία του
Σύμφωνα με το AEMPS, το εμβόλιο PHH-1V «βασίζεται σε δύο ανασυνδυασμένες πρωτεΐνες που είναι δομικά παρόμοιες, η μία αντιστοιχεί στην παραλλαγή άλφα και η άλλη στην παραλλαγή βήτα, που μαζί σχηματίζουν μια μοναδική δομή που ονομάζεται διμερές και που συνοδεύονται από ένα συστατικό που αυξάνει την ανοσοαπόκριση». Αυτός ο συνδυασμός είναι σε θέση να προκαλέσει μια ανοσοαπόκριση σε μία από τις πρωτεΐνες του ιού SARS-CoV-2, γνωστή ως η πρωτεΐνη S σε σχήμα ακίδας, η οποία βοηθά τον ιό να εισέλθει στα ανθρώπινα κύτταρα και να τα καταστρέψει.
Αυτή είναι η ίδια μέθοδος που χρησιμοποιείται από τα εμβόλια Novavax και Sanofi / GSK, τα οποία επί του παρόντος εξετάζονται από τον Ευρωπαϊκό Οργανισμό Φαρμάκων (EMA) για πιθανή έγκριση. Σε αντίθεση με αυτά τα εμβόλια, το PHH-1V έχει πρωτεΐνες από δύο διαφορετικές παραλλαγές, καθώς τροποποιήθηκε για να είναι πιο αποτελεσματικό κατά των νέων μεταλλάξεων του κορονοϊού.
Σύμφωνα με την Hipra, θα μπορούσε να αρχίσει τη φάση κατασκευής σε μόλις π από 60 ημέρες και αναμένει να έχει άδεια από τον Ευρωπαϊκό Οργανισμό Φαρμάκων (EMA) έως το πρώτο τρίμηνο του 2022. Εφόσον οι κλινικές δοκιμές δείξουν θετικά στοιχεία και οι υγειονομικές αρχές εγκρίνουν το ισπανικό εμβόλιο, η Hipra, με έδρα στην Καταλονία εκτιμά πως είναι δυνατόν να παρασκευάσει 400 εκατομμύρια δόσεις το 2022 και 1,2 δισεκατομμύριο το 2023. Όπως έχει ανακοινώσει ηη Hipra, το εν λόγω εμβόλιο θα συντηρείται

















Comments (0)