Ο ΕΜΑ ενέκρινε μία εφάπαξ έγχυση του Bamlanivimab αλλά και του συνδυασμού bamlanivimab με το etesevimab σε ασθενείς με επιβεβαιωμένη COVID-19, ηλικίας 12 ετών και άνω που δεν χρειάζονται συμπληρωματικό οξυγόνο, αλλά διατρέχουν υψηλό κίνδυνο ανάπτυξης σοβαρής COVID-19. Η έγκριση βασίστηκε στη μελέτη BLAZE-1.
Στη μονοθεραπεία η δοσολογία που προβλέπεται είναι 700 mg το συντομότερο δυνατόν μετά από ένα θετικό τεστ και εντός 10 ημερών από την έναρξη των συμπτωμάτων. Στη συνδυαστική θεραπεία η συνιστώμενη δόση σε ενήλικες και παιδιατρικούς ασθενείς (12 ηλικίας και άνω, βάρους τουλάχιστον 40 kg) είναι 700 mg bamlanivimab και 1.400 mg etesevimab, και πάλι το συντομότερο δυνατόν μετά από ένα θετικό τεστ για SARS-CoV-2 και εντός 10 ημερών από την έναρξη των συμπτωμάτων.
Οι ιατροί της Θεραπευτικής Κλινικής της Ιατρικής Σχολής του Εθνικού και Καποδιστριακού Πανεπιστημίου Αθηνών, Ευστάθιος Καστρίτης και Θάνος Δημόπουλος (Πρύτανης ΕΚΠΑ)(https://mdimop.gr/covid19/) συνοψίζουν αυτά τα δεδομένα.
Παρά το γεγονός ότι τα δεδομένα σχετικά με τα οφέλη της μονοθεραπείας δεν είναι τόσο ισχυρά, όπως σχολιάζουν οι επιστήμονες, ο συνδυασμός δείχνει ότι μείωσε το ιϊκό φορτίο περισσότερο από ότι το εικονικό φάρμακο (placebo).
Επίσης, ο συνδυασμός αλλά και η μονοθεραπεία είχαν σαν αποτέλεσμα σε λιγότερες ιατρικές επισκέψεις και εισαγωγές σε νοσοκομείο που να σχετίζονται με την COVID-19.
Ανεπιθύμητες ενέργειες
Η πλειονότητα αυτών που αναφέρθηκαν ήταν ήπιες ή μέτριες. Ωστόσο, αντιδράσεις που σχετίζονται με την έγχυση (συμπεριλαμβανομένων αλλεργικών αντιδράσεων) είναι πιθανές και οι ασθενείς θα πρέπει να λαμβάνουν τα φάρμακα υπό ιατρική παρακολούθηση.
Η λειτουργία τους
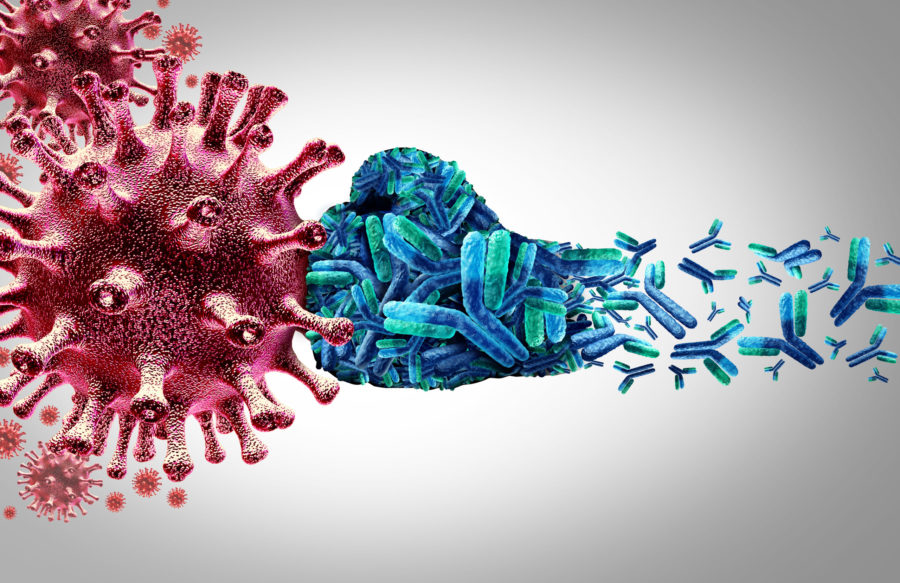
Τα μονοκλωνικά αντισώματα, ως τύπος πρωτεΐνης έχει σχεδιαστεί για να αναγνωρίζει και να προσκολλάται σε μια συγκεκριμένη δομή (που ονομάζεται αντιγόνο). Οπότε το bamlanivimab και το etesevimab προσκολλώνται στην πρωτεΐνη- ακίδα του SARS-CoV-2 σε δύο διαφορετικές θέσεις. Όταν τα αντισώματα αυτά είναι προσκολλημένα στην ακίδα, τότε ο ιός δεν μπορεί να εισέλθει στα κύτταρα του σώματος.
Μελέτη BLAZE-1
Στη τυχαιοποιημένη δοκιμή φάσης 2/3 στις ΗΠΑ, αξιολογήθηκαν μη νοσηλευόμενους ασθενείς (N = 613) με επιβεβαιωμένη λοίμωξη SARS-CoV-2 και οι οποίοι είχαν ένα ή περισσότερα ήπια έως μέτριας βαρύτητας συμπτώματα.
Ο πληθυσμός της μελέτης ήταν ασθενείς που έλαβαν μονοθεραπεία με bamlanivimab ή εικονικό φάρμακο (placebo) (17 Ιουνίου-21 Αυγούστου 2020) και ακολούθως εντάχθηκαν ασθενείς που έλαβαν το συνδυασμό bamlanivimab και etesevimab ή εικονικό φάρμακο (22 Αυγούστου-3 Σεπτεμβρίου).
Οι ασθενείς τυχαιοποιήθηκαν να λάβουν μία εφάπαξ έγχυση bamlanivimab σε διαφορετικές δόσεις (700 mg, 2800 mg ή 7000 mg), τη συνδυαστική θεραπεία (2800 mg bamlanivimab και 2800 mg etesevimab) ή εικονικό φάρμακο.
Το κύριο καταληκτικό σημείο της μελέτης ήταν η μεταβολή του ιϊκού φορτίου του SARS-CoV-2 την ημέρα 11 (± 4 ημέρες) από την έγχυση του φαρμάκου. Επίσης υπήρχαν και άλλα προκαθορισμένα δευτερεύοντα καταληκτικά σημεία που περιλάμβαναν επιπλέον μετρήσεις ιϊκού φορτίου, καταγραφές σχετικές με τα συμπτώματα των ασθενών και ένα μέτρο κλινικής έκβασης που αφορούσε στο ποσοστό των ασθενών που χρειάστηκαν νοσηλεία λόγω COVID-19, επίσκεψη στο τμήμα επειγόντων ή θάνατο την ημέρα 29.
Σε σύγκριση με το εικονικό φάρμακο, οι διαφορές στην λογαριθμική μεταβολή του ιϊκού φορτίου την ημέρα 11 ήταν στατιστικά σημαντικές μόνο για την συνδυαστική θεραπεία των δύο αντισωμάτων.
Διαπιστώθηκε ότι :
- χρειάστηκαν νοσηλεία για COVID-19 ή επισκέφθηκαν το τμήμα επειγόντων ήταν 5,8% (9 συμβάντα) για το εικονικό φάρμακο,
- 1% (1 συμβάν) για την δόση των 700 mg,
- 1,9% (2 συμβάντα) για τα 2800 mg,
- 2,0% (2 συμβάντα) για τα 7000 mg και
- 0,9% (1 συμβάν) για τη συνδυαστική θεραπεία.
Αναφέρθηκαν αντιδράσεις υπερευαισθησίας (αλλεργικές αντιδράσεις) σε 9 ασθενείς (σε 6 που έλαβαν bamlanivimab, δυο που έλαβαν συνδυαστική θεραπεία και σε ένα στο εικονικό φάρμακο). Δεν σημειώθηκαν θάνατοι κατά τη διάρκεια της μελέτης.
















Comments (0)