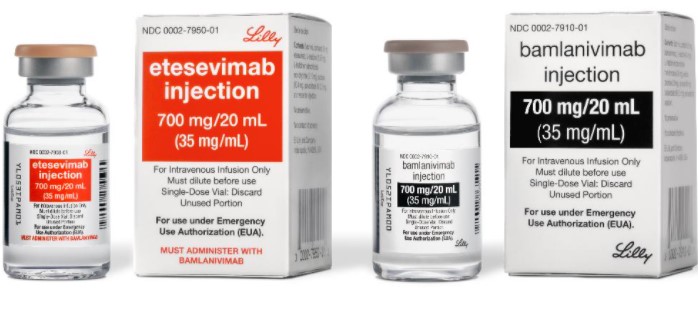
Ο FDA έδωσε άδεια έκτακτης ανάγκης στον συνδυασμό του bamlanivimab της Lilly (LY-CoV555) που χορηγείται με το etesevimab (LY-CoV016) για χορήγηση σε ασθενείς με COVID-19. Σύμφωνα με μελέτη η εν λόγω θεραπευτική αντιμετώπιση φαίνεται πως μείωσε τον κίνδυνο νοσηλείας και θνητότητας κατά 70%.
 Συγκεκριμένα, το bamlanivimab και το etesevimab χορηγήθηκαν για θεραπεία πρόσφατα διαγνωσμένου, ήπιου έως μέτριου COVID-19 σε ασθενείς που διατρέχουν υψηλό κίνδυνο να εξελιχθεί σε σοβαρό COVID-19. Σημειώνεται ότι ο FDA εγκρίνει ακόμη συντομευμένο χρόνο έγχυσης και για τις δύο θεραπείες εξουδετερωτικών αντισωμάτων της Lilly που έχουν εγκριθεί για επείγουσα χρήση.
Συγκεκριμένα, το bamlanivimab και το etesevimab χορηγήθηκαν για θεραπεία πρόσφατα διαγνωσμένου, ήπιου έως μέτριου COVID-19 σε ασθενείς που διατρέχουν υψηλό κίνδυνο να εξελιχθεί σε σοβαρό COVID-19. Σημειώνεται ότι ο FDA εγκρίνει ακόμη συντομευμένο χρόνο έγχυσης και για τις δύο θεραπείες εξουδετερωτικών αντισωμάτων της Lilly που έχουν εγκριθεί για επείγουσα χρήση.
Εκτιμάται ότι περισσότερες από 250.000 δόσεις θα κατασκευαστούν σε όλο το πρώτο τρίμηνο του 2021 και έως 1 εκατομμύριο δόσεις έως τα μέσα του 2021.
Αναλυτικά, ο FDA χορήγησε άδεια έκτακτης ανάγκης (EUA) για bamlanivimab (LY-CoV555) 700 mg και etesevimab (LY-CoV016) 1400 mg μαζί, η Eli Lilly and Company (NYSE: LLY).
Αυτή η θεραπεία έχει εγκριθεί για τη θεραπεία του ήπιου έως μέτριου COVID-19 σε ασθενείς ηλικίας 12 ετών και άνω που διατρέχουν υψηλό κίνδυνο να προχωρήσουν σε σοβαρή COVID-19 ή / και νοσηλεία.
Χορήγηση
Το bamlanivimab και το etesevimab θα πρέπει να χορηγούνται μαζί με μία μόνο ενδοφλέβια έγχυση το συντομότερο δυνατόνμετά από θετικό τεστ COVID-19 και εντός 10 ημερών από την έναρξη των συμπτωμάτων.
Επιπλέον, το FDA έχει εγκρίνει τους χρόνους έγχυσης να είναι πιο σύντομοι, 16 ή 21λεπτά, αντίστοιχα, δηλαδή μια σημαντική μείωση από τον προηγούμενο εγκεκριμένο χρόνο των 60 λεπτών, με στόχο την μείωση του φόρτου για το σύστημα υγειονομικής περίθαλψης.
«Η Lilly έχει αφιερώσει το χρόνο, τους πόρους και την τεχνογνωσία μας για να ανακαλύψουμε και να αναπτύξουμε θεραπείες για τη θεραπεία του COVID-19», επεσήμανε ο Daniel Skovronsky, M.D., Ph.D.,επικεφαλής επιστημονικός διευθυντής της Lill y και πρόεδρος των Lilly Research Laboratories.
«Το Bamlanivimab μόνο με άδεια έκτακτης ανάγκηςήδη παρείχε σε πολλούς ανθρώπους μια επιλογή πρώιμης θεραπείας που θα μπορούσε να αποτρέψει νοσηλεία και είμαστε ενθουσιασμένοι που τώρα προσθέτουμε μια επιπλέον θεραπευτική επιλογή με παρόμοιο αποδεδειγμένο κλινικό όφελος. Επιπλέον, με τον κίνδυνο εμφάνισης αντίστασης καθώς προκύπτουν διάφορα στελέχη του ιού, το bamlanivimab και το etesevimab από κοινού θα μπορούσε ενδεχομένως να επιτρέψει την αποτελεσματικότητα έναντι ενός ευρύτερου φάσματος φυσικών παραλλαγών SARS-CoV-2 καθώς αυτά τα νέα στελέχη εξαπλώνονται σε όλο τον κόσμο».
Σημειώνεται ότι η άδεια EUA βασίζεται σε δεδομένα της Φάσης 3 από τη δοκιμή BLAZE-1, που ανακοινώθηκε στις 26 Ιανουαρίου 2021, η οποία έδειξε ότι μαζί τα bamlanivimab και etesevimab μείωσαν τον κίνδυνο νοσηλείας και θνητότητας κατά 70%. Αυτά τα δεδομένα επιβεβαιώνουν προηγούμενα αποτελέσματα, που δημοσιεύθηκαν στο The Journal of the American, Ιατρική ένωση.



















Comments (0)