Η Novartis ανακοίνωσε ότι έγιναν δεκτές οι αιτήσεις έγκρισης, που υπέβαλε στην αμερικανική Υπηρεσία Τροφίμων και Φαρμάκων των ΗΠΑ (FDA) και τον Ευρωπαϊκό Οργανισμό Φαρμάκων (EMA) για το φάρμακο Beovu (brolucizumab) ως θεραπεία ασθενών με διαβητικό οίδημα ωχράς κηλίδας.
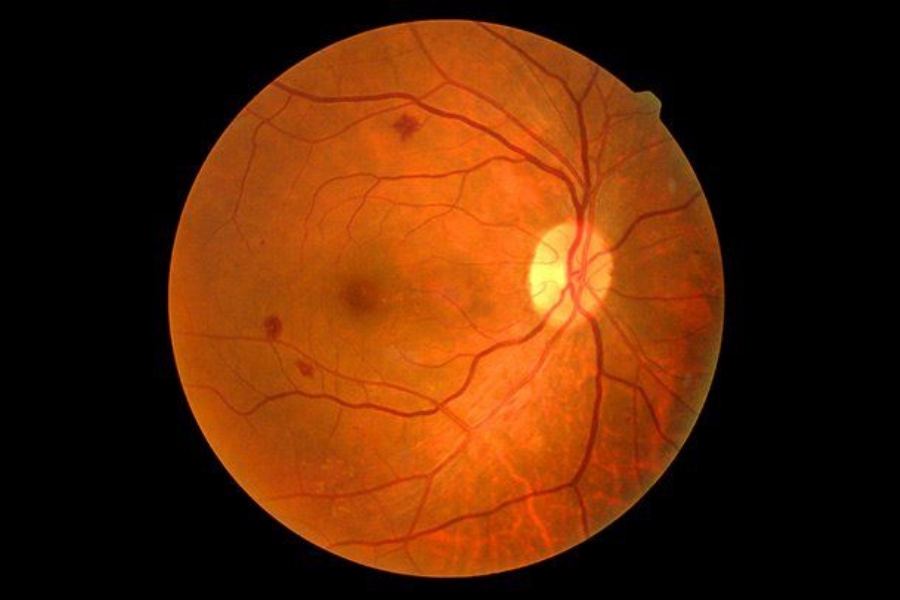
Η πάθηση αυτή είναι η κύρια αιτία τύφλωσης σε ενήλικες στις ανεπτυγμένες χώρες, επηρεάζοντας το 12% των ατόμων με διαβήτη τύπου 1 και το 28% των ατόμων με διαβήτη τύπου 2. Το διαβητικό οίδημα ωχράς κηλίδας προσβάλει την ωχρά κηλίδα, δηλαδή το τμήμα του αμφιβληστροειδούς που βρίσκεται στο πίσω μέρος του οφθαλμού. Η ωχρά κηλίδα είναι η περιοχή του οφθαλμού που σχετίζεται άμεσα με την κεντρική όραση.
Στα άτομα με διαβήτη, τα χρονίως υψηλά επίπεδα γλυκόζης στο αίμα μπορεί να προκαλέσουν βλάβη στα αιμοφόρα αγγεία του οφθαλμού. Τα κατεστραμμένα αιμοφόρα αγγεία διαρρέουν στον αμφιβληστροειδή και η συσσώρευση αυτού του υγρού προκαλεί βλάβη στον αμφιβληστροειδή και απώλεια της όρασης. Σε ορισμένες περιπτώσεις, τα μη φυσιολογικά νέα αιμοφόρα αγγεία αρχίσουν να αναπτύσσονται κάτω από την ωχρά κηλίδα, πιθανώς συμβάλλοντας στην απώλεια της όρασής σας.
Οι αιτήσεις έγκρισης βασίζονται στα θετικά ευρήματα δύο μελετών (KESTREL και KITE), που έδειξαν καλύτερα αποτελέσματα στους ασθενείς, σε σχέση με το aflibercept. Οι πιο συχνές οφθαλμικές και μη οφθαλμικές ανεπιθύμητες ενέργειες (πάνω από το 5% των ασθενών) ήταν αιμορραγία επιπεφυκότα, ρινοφαρυγγίτιδα και υπέρταση. Οι αποφάσεις από FDA και ΕΜΑ αναμένονται στα μέσα του 2022.
















Comments (0)