O FDA ενέκρινε τo ivosidenib (Tibsovo) για ενήλικες ασθενείς με υποτροπιάζοντα ή ανθεκτικά μυελοδυσπλαστικά σύνδρομα (MDS) με παρουσία μετάλλαξης της ισοκιτρικής αφυδρογονάσης-1 (IDH1), όπως ανιχνεύεται με εγκεκριμένο από τον FDA διαγνωστικό τεστ. Μελέτη έδειξε ότι το 39% των ασθενών πέτυχαν πλήρη ύφεση, ενώ το 67% των ασθενών που ήταν εξαρτημένοι από μεταγγίσεις ανεξαρτητοποιήθηκαν.
Ειδικότερα, οι υπάρχουσες θεραπευτικές επιλογές για τους συγκεκριμένους ασθενείς είναι περιορισμένες και λιγότεροι από τους μισούς ασθενείς είναι υποψήφιοι να λάβουν εγκεκριμένες θεραπείες. Οι περισσότερες από τις εγκεκριμένες θεραπείες καθυστερούν την εξέλιξη της νόσου, προσφέρουν ανταπόκριση για κάποιο διάστημα αλλά δεν οδηγούν σε ίαση καθώς οι ασθενείς θα εμφανίσουν αντίσταση ή υποτροπή.
Όσο αφορά την νέα θεραπεία η έγκρισή της βασίστηκε στα αποτελέσματα της κλινικής μελέτης AG120-C-001 στην οποία εντάχθηκαν μόλις 18 ενήλικες ασθενείς με υποτροπιάζον/ανθεκτικό MDS. Τα στοιχεία παρουσιάζουν περιληπτικά οι ιατροί της Θεραπευτικής Κλινικής (Νοσοκομείο Αλεξάνδρα) της Ιατρικής Σχολής του Εθνικού και Καποδιστριακού Πανεπιστημίου Αθηνών, Δέσποινα Φωτίου και Θάνος Δημόπουλος (Καθηγητής Θεραπευτικής – Αιματολογίας – Ογκολογίας).
Κατηγοριοποίηση ασθενών
Οι ασθενείς με MDS ταξινομούνται κατά το Διεθνές Προγνωστικό Σύστημα ως πολύ χαμηλού κινδύνου, χαμηλού κινδύνου, ενδιάμεσου κινδύνου, υψηλού και πολύ υψηλού κινδύνου για εξέλιξη σε οξεία μυελογενή λευχαιμία και για την εκτιμώμενη επιβίωσή τους. Αντίστοιχα, η θεραπεία είναι ανάλογη της κατηγορίας κινδύνου, της ηλικίας, της βαρύτητας της κυτταροπενίας και του μοριακού προφίλ της νόσου.
Για τους ασθενείς χαμηλού κινδύνου
- Με ανωμαλία χρωμοσωμάτων del (5q) έχει ένδειξη η θεραπευτική αγωγή με λεναλιδομίδη από του στόματος.
- Με την παρουσία δακτυλιοειδών σιδηροβλαστών, οι οποίοι φέρουν συνήθως την μετάλλαξη SF3B1, ενδείκνυται θεραπευτική αγωγή με luspatercept (Rebrozyl).
- Στις υπόλοιπες όμως περιπτώσεις χαμηλού κινδύνου MDS η αντιμετώπιση περιλαμβάνει υποστήριξη με αιμοποιητικούς παράγοντες όπως είναι η ερυθροποιητίνη και αυξητικό παράγοντα των λευκοκυττάρων. Προσφάτως έλαβε έγκριση από τον FDA το luspatercept και σε όλους τους ασθενείς με χαμηλού/ενδιάμεσου κινδύνου MDS οι οποίοι εξαρτώνται από μεταγγίσεις στην πρώτη γραμμή θεραπείας.
Ενδιάμεσου /υψηλού κινδύνου
- Με ηλικία κάτω των 65 ετών και δεν παρουσιάζουν συ νοσηρότητες είναι υποψήφιοι για αλλογενή μεταμόσχευση μυελού των οστών.
- Εφόσον δεν πληρούνται τα κριτήρια για αλλογενή μεταμόσχευση, η βασική θεραπευτική επιλογή είναι η χημειοθεραπεία με υπομεθυλιωτικούς παράγοντες όπως είναι η αζακιτιδίνη (azacytidine) ή η δεσιταβίνη (decitabine). Η αποτελεσματικότητα της αγωγής με τους παραπάνω παράγοντες είναι μέτρια. Στις ΗΠΑ είναι διαθέσιμο και ένα σκεύασμα από του στόματος με συνδυασμό του decitabine με το cedazuridine, έναν αναστολέα της απαμινάσης της κυτιδίνης (Inqovi).
- Εάν δεν είναι επιλέξιμοι για εντατική χημειοθεραπεία ο συνδυασμός azacytidine με τον bcl-2 αναστολέα venetoclax, που χορηγείται σε ασθενείς με οξεία μυελογενή λευχαιμία και φαίνεται να έχει ενθαρρυντικά αποτελέσματα σε ασθενείς με MDS υψηλού κινδύνου.
Το ivosidenib
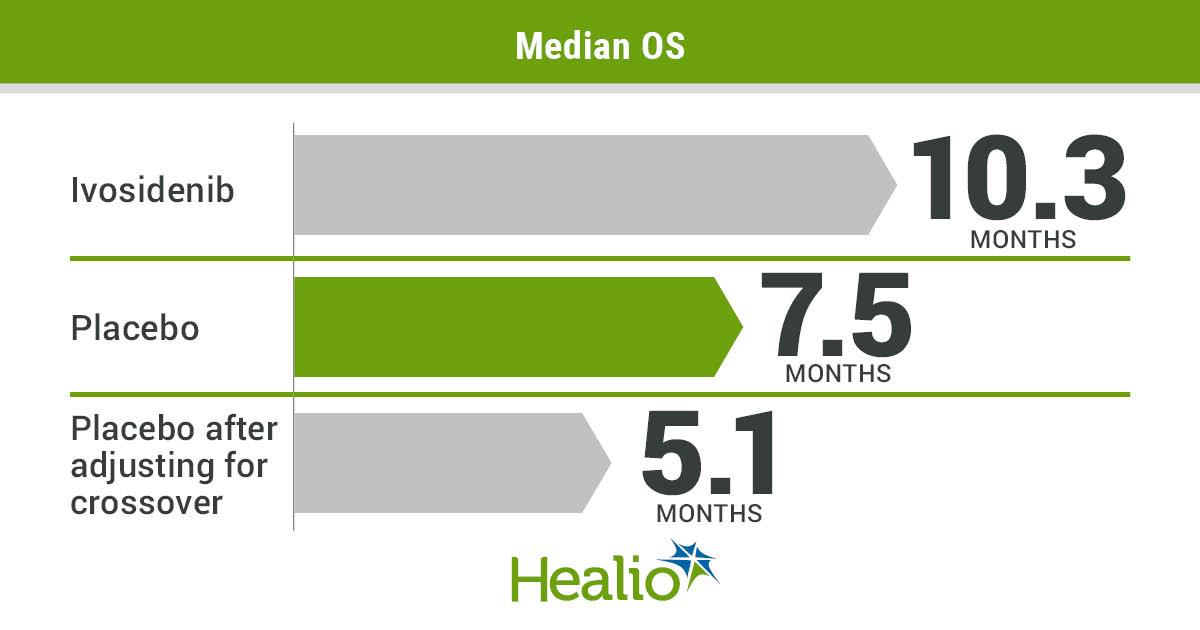
Στην φαρέτρα των γιατρών προστίθεται το ivosidenib με βάση την πρόσφατη έγκριση από τον FDA. Στη μελέτη, όλοι οι ασθενείς είχαν ανιχνεύσιμη μετάλλαξη IDH1 είτε στο περιφερικό αίμα είτε στον μυελό των οστών. Το ivosidenib χορηγήθηκε από το στόμα σε αρχική δόση 500 mg ημερησίως συνεχώς για κύκλους 28 ημερών μέχρι την εξέλιξη της νόσου, τη μη αποδεκτή τοξικότητα ή την αλλογενή μεταμόσχευση αιμοποιητικών κυττάρων. Η διάμεση διάρκεια της θεραπείας ήταν 9.3 μήνες. Το 39% των ασθενών πέτυχαν πλήρη ύφεση, ενώ το 67% των ασθενών που ήταν εξαρτημένοι από μεταγγίσεις ανεξαρτητοποιήθηκαν Οι πιο συχνές ανεπιθύμητες ενέργειες ήταν οι γαστρεντερικές διαταραχές, αρθραλγία, κόπωση, βήχας, μυαλγίες και εξάνθημα.






















Comments (0)