Η έγκριση του Xofigo 1000 kBq/ml (Radium-223 Chloride), που βασίζεται σε στοιχεία μελέτης Φάσης ΙΙΙ ALSYMPCA, επήλθε μετά τη θετική σύσταση από την Ευρωπαϊκή Επιτροπή Φαρμάκων για Ανθρώπινη Χρήση (CHMP) τον περασμένο Σεπτέμβριο του 2013. Το σκεύασμα συστήθηκε για τη θεραπεία ασθενών με ανθεκτικό στον ευνουχισμό καρκίνο προστάτη (CRPC) που έχουν συμπτωματικές οστικές μεταστάσεις και χωρίς γνωστές σπλαχνικές μεταστάσεις. Σε αυτούς τους ασθενείς, το συγκεκριμένο ραδιοφάρμακο φαίνεται να δίνει όφελος στην συνολική επιβίωση και να καθυστερεί την εμφάνιση σκελετικών συμβαμάτων σε σύγκριση με το «best standard of care», δηλαδή με δεύτερης γραμμής ορμονοθεραπεία συν διφωσφονικά. Δεν υπάρχουν τυχαιοποιημένες μελέτες που να συγκρίνουν το Radium-223 με άλλους παράγοντες που αποδεδειγμένα δίνουν όφελος στην επιβίωση στον μεταστατικό ευνουχοάντοχο καρκίνο προστάτη.
Το Xofigo, έδειξε βελτιώσεις στην επιβίωση του ασθενούς (OS) συγκριτικά με εικονικό φάρμακο, στη διάρκεια βασικής μελέτης φάσης ΙΙΙ ALSYMPCA και ενδείκνυται (αναλυτικότερα) σε ασθενείς με καρκίνο του προστάτη στους οποίους: • Ο καρκίνος έχει εξαπλωθεί στα οστά αλλά όχι στα άλλα όργανα • Ο καρκίνος δεν ανταποκρίνονται στην ορμονoθεραπεία ή στην χειρουργική που μπλοκάρει την παραγωγή τεστοστερόνης • Ο καρκίνος που έχει εξαπλωθεί, στα οστά προκαλεί και άλλα σοβαρά συμπτώματα.
Να σημειωθεί πως τον Σεπτέμβριο του 2009, η Bayer και η Algeta υπέγραψαν συμφωνία για την ανάπτυξη και την εμπορική διάθεση του Xofigo. Στο πλαίσιο αυτής της συμφωνίας, η Bayer θα αναπτύξει το Xofigo σε παγκόσμιο επίπεδο, ενώ η Algeta «συνδράμει» (μαζί με την Bayer) στην αγορά των ΗΠΑ.
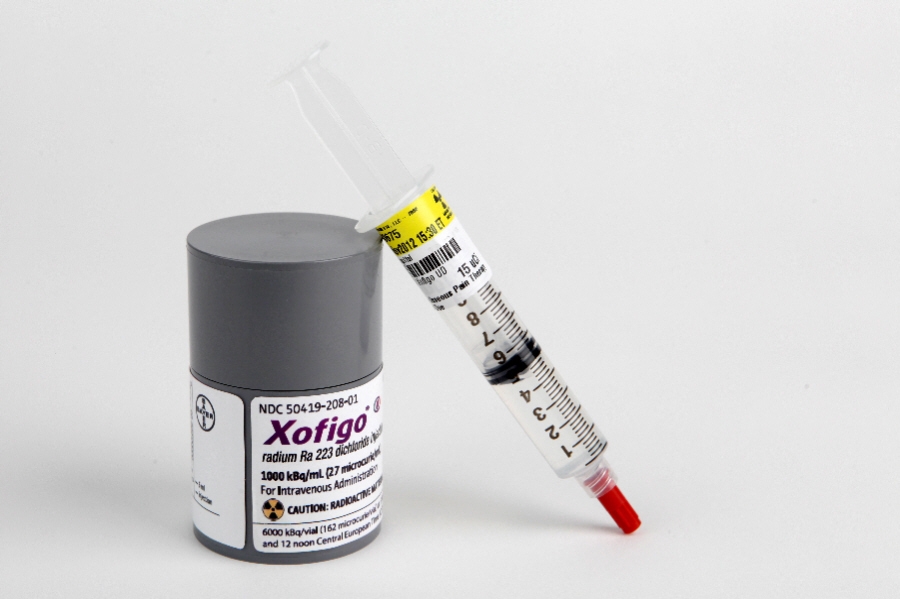
Άδειας κυκλοφορίας «κερδίζει» το Xofigo της Bayer
Σχετικά άρθρα
Περιοδικό Pharma & Health Business

Δημοφιλή
 Ποιος είναι ο Εμμανουήλ Φανδρίδης ο χειρουργός που ανέλαβε την επέμβαση της Μαρέβας Μητσοτάκη
Ποιος είναι ο Εμμανουήλ Φανδρίδης ο χειρουργός που ανέλαβε την επέμβαση της Μαρέβας Μητσοτάκη  Ξεκίνησε η υποβολή αιτήσεων για την Προκήρυξη 1Κ/2026 – 510 μόνιμες θέσεις στο Υπουργείο Υγείας
Ξεκίνησε η υποβολή αιτήσεων για την Προκήρυξη 1Κ/2026 – 510 μόνιμες θέσεις στο Υπουργείο Υγείας  Πρώτη ολοκληρωμένη μελέτη για την Ενιαία Υγεία στην Ελλάδα: Έκθεση-ορόσημο για τις υγειονομικές απειλές
Πρώτη ολοκληρωμένη μελέτη για την Ενιαία Υγεία στην Ελλάδα: Έκθεση-ορόσημο για τις υγειονομικές απειλές  Γιατρός του Κρατικού Νίκαιας διαψεύδει τους ισχυρισμούς Γεωργιάδη για τα επεισόδια στο νοσοκομείο
Γιατρός του Κρατικού Νίκαιας διαψεύδει τους ισχυρισμούς Γεωργιάδη για τα επεισόδια στο νοσοκομείο  Πάνος Παπανικολάου: Υποψήφιος Δήμαρχος Περιστερίου
Πάνος Παπανικολάου: Υποψήφιος Δήμαρχος Περιστερίου  Η Ευρώπη σε κρίσιμη καμπή για τις κλινικές δοκιμές
Η Ευρώπη σε κρίσιμη καμπή για τις κλινικές δοκιμές














Comments (0)