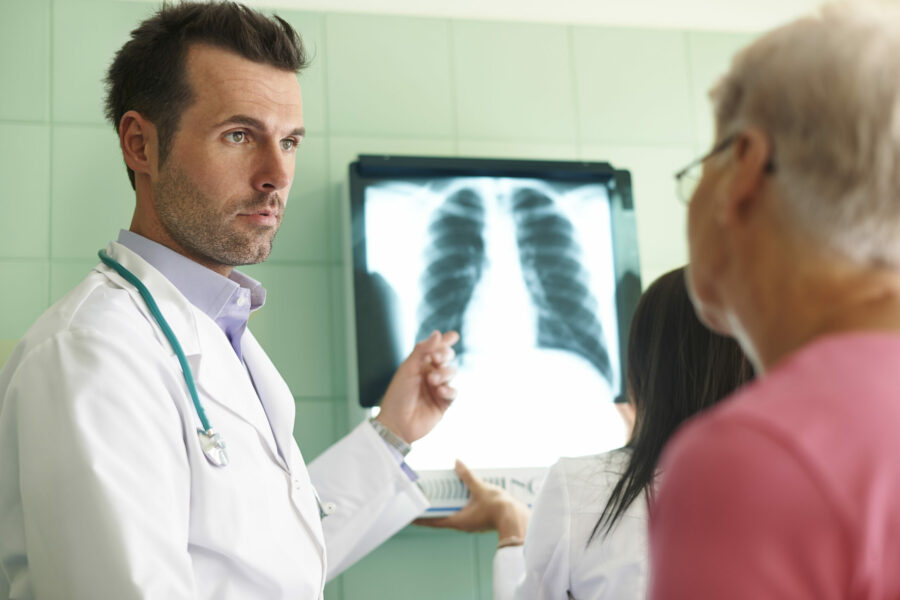
Το πράσινο φως έδωσε η Ευρωπαϊκή Επιτροπή στο sotatercept σε συνδυασμό με άλλες υπάρχουσες θεραπείες με στόχο την αντιμετώπιση της Πνευμονικής Αρτηριακής Υπέρτασης (ΠΑΥ) σε ενήλικες ασθενείς με Λειτουργική Κατηγορία (FC) II έως III.
Πρόκειται για τη πρώτη θεραπεία με αναστολέα σηματοδότησης της ακτιβίνης για την ΠΑΥ που εγκρίνεται στην Ευρώπη. Πλέον θα έχουν μια νέα θεραπευτική επιλογή για ενήλικες με αυτή τη σπάνια, προοδευτική νόσο. Η θεραπεία θα χορηγείται σε ενήλικες ασθενείς με Λειτουργική Κατηγορία (FC) II έως III του Παγκόσμιου Οργανισμού Υγείας (ΠΟΥ), προκειμένου να καλυτερεύσουν την ικανότητα άσκησης. Το Sotatercept είχε ενταχθεί στο πρόγραμμα PRIority MEdicines (PRIME) του EMA, το οποίο παρέχει έγκαιρη και ενισχυμένη επιστημονική και κανονιστική υποστήριξη σε φάρμακα που έχουν ιδιαίτερη δυνατότητα να αντιμετωπίσουν τις ανεκπλήρωτες ιατρικές ανάγκες των ασθενών.
Κλινική δοκιμή STELLAR
Η έγκριση της Ευρωπαϊκής Επιτροπής βασίζεται στα αποτελέσματα ασφάλειας και αποτελεσματικότητας της STELLAR μια τυχαιοποιημένη, διπλή τυφλή, ελεγχόμενη με εικονικό φάρμακο, πολυκεντρική, κλινική δοκιμή Φάσης 3. Τα ευρήματα έδειξαν ότι οι ασθενείς που λάμβαναν sotatercept είχαν σημαντικά βελτιωμένη ικανότητα άσκησης, μετρούμενη από το πόσο μακριά ήταν σε θέση να περπατήσουν μέσα σε έξι λεπτά (“6 Minute Walk Test”) κατά την έναρξη της θεραπείας και μετά από 24 εβδομάδες. Αυτή η βελτίωση θεωρείται κλινικά σημαντική καθώς συγκρίνεται με τα αποτελέσματα της βασικής μελέτης ήδη εγκεκριμένων προϊόντων για την ΠΑΥ.
Στο πλαίσιο της δοκιμής αξιολογήθηκε η αποτελεσματικότητα και η ασφάλεια του sotatercept σε 323 ενήλικες με ΠΑΥ σε σταθερή θεραπεία για περισσότερες από 90 ημέρες συγκριτικά με τη βασική θεραπεία ΠΑΥ (μονοθεραπεία ή συνδυαστική θεραπεία). Τα αποτελέσματα της κλινικής μελέτης έχουν δημοσιευθεί στο επιστημονικό περιοδικό The New England Journal of Medicine.
Η Πνευμονική Αρτηριακή Υπέρταση (ΠΑΥ)
Είναι μια σπάνια, μακροχρόνια, εξουθενωτική και απειλητική για τη ζωή κατάσταση κατά την οποία οι ασθενείς έχουν ασυνήθιστα υψηλή αρτηριακή πίεση στις αρτηρίες στους πνεύμονες. Πολλοί ασθενείς αντιμετωπίζουν δυσκολία στην αναπνοή που περιορίζει τη σωματική τους δραστηριότητα. Παρά τις εγκεκριμένες θεραπείες, η μακροπρόθεσμη πρόγνωση παραμένει κακή: υπολογίζεται ότι περίπου το 50% των ασθενών θα πεθάνει εντός πέντε έως επτά ετών μετά τη διάγνωση. Σήμερα υπολογίζεται ότι περίπου 40.000 άτομα στις ΗΠΑ και 30.000 στην Ευρωπαϊκή Ένωση πάσχουν από ΠΑΥ.
Sotatercept
Η δράση της έγκειται στον αναστολέα σηματοδότησης ακτιβίνης. Στο σώμα, οι πρωτεΐνες που ονομάζονται ακτιβίνες συνδέονται με έναν υποδοχέα που ονομάζεται ActRIIA για να διεγείρουν την ανάπτυξη των κυττάρων που αποτελούν τα αιμοφόρα αγγεία. Αυτοί οι υποδοχείς είναι υπερβολικά ενεργοί σε ασθενείς με ΠΑΥ. Το sotatercept είναι αντίγραφο του ActRIIA και επειδή συνδέεται επίσης με ακτιβίνες, τις εμποδίζει να ενεργοποιήσουν τον υποδοχέα. Με αυτόν τον τρόπο, το sotatercept ρυθμίζει την ανάπτυξη νέων αιμοφόρων αγγείων στους πνεύμονες. Αυτό οδηγεί σε μειωμένη στένωση και πάχυνση των αιμοφόρων αγγείων, βελτιώνοντας έτσι τα συμπτώματα της νόσου.
Το φάρμακο χορηγείται (με υποδόρια έγχυση) μία φορά κάθε τρεις εβδομάδες . Μπορεί να χορηγηθεί από τους ίδιους τους ασθενείς ή τους φροντιστές τους με καθοδήγηση, εκπαίδευση και παρακολούθηση από επαγγελματία υγείας.
Ανεπιθύμητες ενέργειες
Οι πιο συχνές είναι πονοκέφαλος, ρινορραγίες, εξάνθημα, μικροσκοπικά αιμοφόρα αγγεία που μοιάζουν με ροζ ή κόκκινες γραμμές στο δέρμα (τελαγγειεκτασία), διάρροια, ζάλη και ερυθρότητα. Αν και το sotatercept είναι γενικά καλά ανεκτό, έχουν υπάρξει σπάνιες αναφορές σοβαρών παρενεργειών που επηρεάζουν το αίμα, όπως είναι αυξημένη αρτηριακή πίεση, χαμηλός αριθμός αιμοπεταλίων (θρομβοπενία) που μπορεί να αυξήσει τον κίνδυνο αιμορραγίας και αυξημένες συγκεντρώσεις αιμοσφαιρίνης που μπορεί να οδηγήσουν σε θρομβοεμβολικά επεισόδια, όπως είναι εγκεφαλικό επεισόδιο. Οι δύο τελευταίες καταστάσεις που αναφέρονται θεωρούνται διαχειρίσιμες με τροποποίηση της δόσης του sotatercept.



















Comments (0)