Ένα βήμα βρισκόμαστε πριν την έγκριση στις ΗΠΑ μίας πρωτοποριακής θεραπείας για ασθενείς με οξεία λεμφοβλαστική λευχαιμία. Η αρμόδια επιτροπή ογκολογικών θεραπειών του Αμερικανικού Οργανισμού Φαρμάκων ενέκρινε ομόφωνα τη χορήγηση άδειας κυκλοφορίας του φαρμάκου CTL019 (tisagenlecleucel), που είναι η πρώτη μίας νέας κατηγορίας ανοσοθεραπείας.
Η οξεία λεμφοβλαστική λευχαιμία αντιπροσωπεύει το 25% των νέων διαγνώσεων καρκίνου σε παιδιά κάτω των 15 ετών και είναι η πιο συχνή μορφή παιδικού καρκίνου στις ΗΠΑ. Οι θεραπευτικές επιλογές είναι περιορισμένες και σε παιδιά και νεαρούς ενήλικες, στις οποίες η νόσος έχει υποτροπιάσει και δεν ανταποκρίνονται πλέον, το ποσοστό επιβίωσης στην πενταετία είναι μικρότερο από 30%.
Η νέα θεραπεία ανήκει σε μία νέα κατηγορία ανοσοθεραπείας με την ονομασία CAR-T, η οποία εξατομικεύεται ανάλογα με τον ασθενή. Στη διάρκεια της διαδικασίας, Τ κύτταρα του ανοσοποιητικού συστήματος λαμβάνονται από το αίμα του ασθενή και στη συνέχεια επαναπρογραμματίζονται χάρη σε έναν ειδικό υποδοχέα αντιγόνου (chimeric antigen receptor – CAR), ο οποίος βοηθά τα Τ κύτταρα να αναγνωρίσουν τα καρκινικά κύτταρα. Στη συνέχεια τα Τ κύτταρα αναγνωρίζουν τα καρκινικά ως ξένα και επιτίθενται με σκοπό να τα εξολοθρεύσουν.
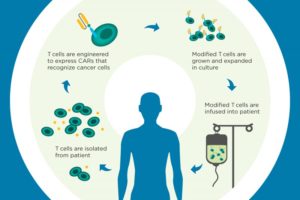
Η νέα θεραπεία έχει αναπτυχθεί από την Novartis. Η εταιρεία κατέθεσε αίτηση έγκρισης στις ΗΠΑ βασιζόμενη στα δεδομένα κλινικών μελετών, που παρουσιάστηκαν στο ετήσιο συνέδριο της Αμερικανικής Εταιρείας Αιματολογίας τον περασμένο Δεκέμβριο και έδειξαν ότι 41 από τους 50 ασθενείς (ποσοστό 82%) είχαν πλήρη ύφεση της νόσου.
Η αίτηση της Novartis βρίσκεται υπό εξέταση κατά προτεραιότητα λόγω της αξίας της νέας θεραπείας και η σχετική απόφαση αναμένεται να έχει ληφθεί έως τις 3-10-2017. Μία ανάλογη θεραπεία της εταιρείας KITE Pharma που αφορά τη θεραπεία λεμφώματος non-Hodgkin αναμένεται το Νοέμβριο.

Πρωτοποριακή ανοσοθεραπεία για λευχαιμία
Σχετικά άρθρα
Περιοδικό Pharma & Health Business

Δημοφιλή
 Κρίση στην επάρκεια αίματος: Σοβαρές ελλείψεις θέτουν σε κίνδυνο ασθενείς με Θαλασσαιμία και Δρεπανοκυτταρική Νόσο
Κρίση στην επάρκεια αίματος: Σοβαρές ελλείψεις θέτουν σε κίνδυνο ασθενείς με Θαλασσαιμία και Δρεπανοκυτταρική Νόσο  Η προκήρυξη 2Κ/2026 φέρνει τη μεγαλύτερη ενίσχυση φυσικοθεραπευτών στο ΕΣΥ εδώ και 15 χρόνια
Η προκήρυξη 2Κ/2026 φέρνει τη μεγαλύτερη ενίσχυση φυσικοθεραπευτών στο ΕΣΥ εδώ και 15 χρόνια  Ημερίδα ΕΟΦ : Νέα στρατηγική, ψηφιακός μετασχηματισμός και ενίσχυση της φαρμακευτικής πολιτικής
Ημερίδα ΕΟΦ : Νέα στρατηγική, ψηφιακός μετασχηματισμός και ενίσχυση της φαρμακευτικής πολιτικής  Νέο πλαίσιο εφημεριών για φαρμακοποιούς και επιστήμονες υγείας στα νοσοκομεία και άλλες δομές το 2026
Νέο πλαίσιο εφημεριών για φαρμακοποιούς και επιστήμονες υγείας στα νοσοκομεία και άλλες δομές το 2026  Υποβάθμιση μαιευτικής φροντίδας: Η ΝΙΚΗ αποδίδει πολιτικές ευθύνες στο Υπουργείο Υγείας
Υποβάθμιση μαιευτικής φροντίδας: Η ΝΙΚΗ αποδίδει πολιτικές ευθύνες στο Υπουργείο Υγείας  Νέο πλαίσιο για την Ψυχική Υγεία: Ρυθμίσεις που αλλάζουν τον χάρτη εποπτείας και ποιότητας
Νέο πλαίσιο για την Ψυχική Υγεία: Ρυθμίσεις που αλλάζουν τον χάρτη εποπτείας και ποιότητας















Comments (0)