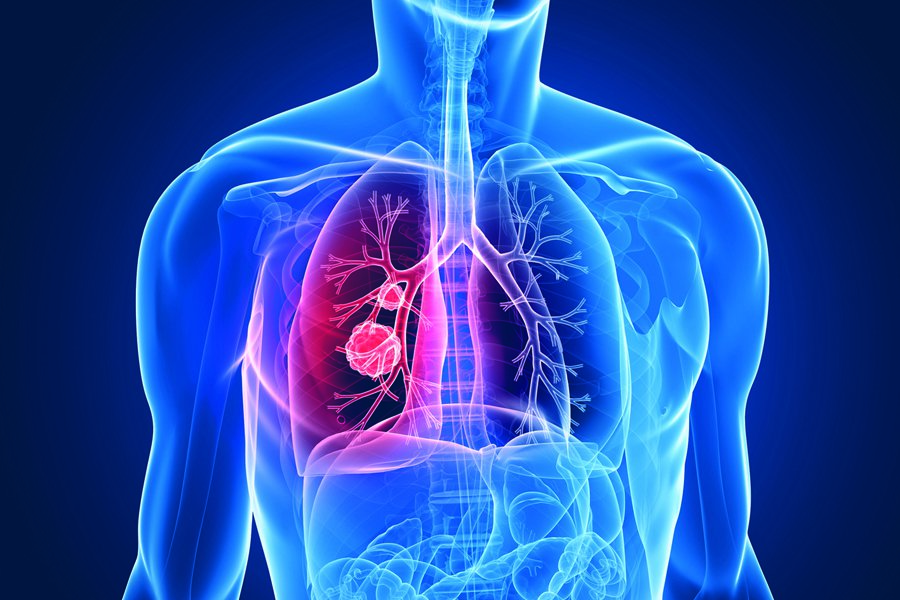
Εγκρίθηκε στις ΗΠΑ ένα νέο φάρμακο για ορισμένες μορφές καρκίνου του πνεύμονα. Πρόκειται για το Vizimpro (dacomitinib) που ενδείκνυται ως πρώτης γραμμής θεραπεία σε ασθενείς με τοπικά προχωρημένο ή μεταστατικό μη μικροκυτταρικό καρκίνο του πνεύμονα (NSCLC), ο οποίος φέρει συγκεκριμένες μεταλλάξεις.
Η έγκριση βασίστηκε στα αποτελέσματα της μελέτης ARCHER 1050 η οποία έδειξε ότι το Vizimpro μπορεί να προσφέρει κλινικά σημαντική βελτίωση σε σχέση με το gefitinib, μειώνοντας κατά 41% του κινδύνου εξέλιξης της νόσου ή του θανάτου.
Ειδικότερα, οι ασθενείς που έλαβαν dacomitinib στη μελέτη εμφάνισαν μέση επιβίωση χωρίς εξέλιξη της νόσου (PFS) 14,7 μηνών σε σύγκριση με 9,2 μήνες σε ασθενείς που έλαβαν θεραπεία με gefitinib.
Το νέο φάρμακο ανήκει σε μία νέα κατηγορία φαρμάκων που ονομάζονται αναστολείς της κινάσης της τυροσίνης του EGFR, τα οποία αναστέλλουν τη λειτουργία του υποδοχέα του επιδερμικού αυξητικού παράγοντα (Epidermal Growth Factor Receptor, EGFR).
Το γονίδιο αυτό είναι το πιο συχνό, που εμφανίζει μεταλλάξεις στον καρκίνο του πνεύμονα. Υπολογίζεται ότι στο 10-15% των ασθενών με μη μικροκυτταρικό καρκίνο του πνεύμονα (NSCLC), το DNA του όγκου έχει μεταλλάξεις, οι οποίες ευνοούν την εξέλιξη και επέκταση του καρκίνου.
Γενικά, ο μη μικροκυτταρικός καρκίνος του πνεύμονα (NSCLC) αφορά το 85% των περιπτώσεων καρκίνων του πνεύμονα. Το νέο φάρμακο έχει αναπτυχθεί από την αμερικανική Pfizer, η οποία έχει υποβάλει αίτηση για έγκριση και στην Ε.Ε.


















Comments (0)