Την κατά προτεραιότητα εξέταση του θεραπευτικού συνδυασμού του pembrolizumab με χημειοθεραπεία (πεμετρεξίδη και καρβοπλατίνη), ως θεραπεία πρώτης γραμμής για ασθενείς με μεταστατικό ή προχωρημένο μη πλακώδη μη μικροκυτταρικό καρκίνο του πνεύμονα (ανεξαρτήτως της έκφρασης του PD-L1 στους όγκους τους και χωρίς γονιδιωματικές αλλοιώσεις EGFR ή ALK), αποφάσισε ο Αμερικανικός Οργανισμός Τροφίμων και Φαρμάκων (FDA).
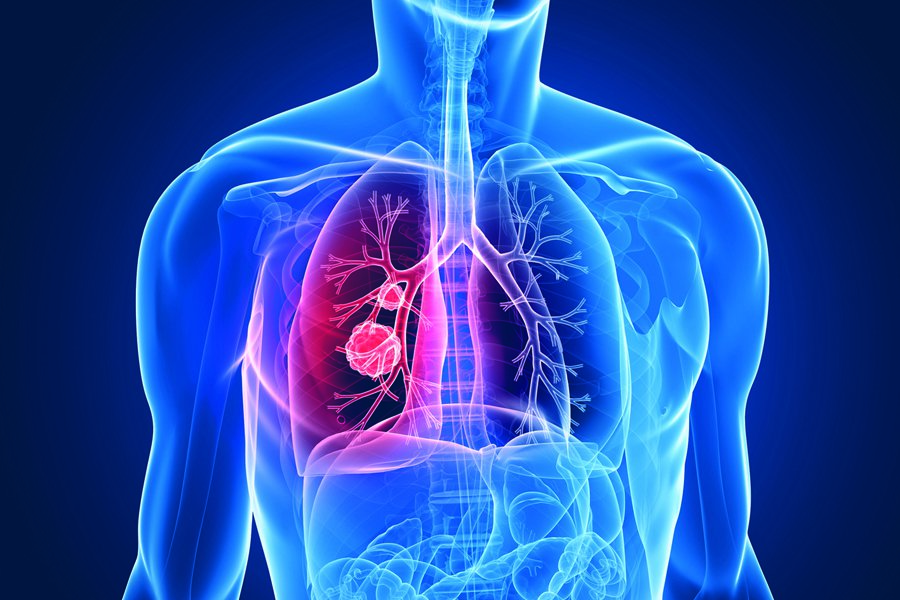
Ο καρκίνος του πνεύμονα αποτελεί την κύρια αιτία θανάτου από καρκίνο παγκοσμίως, καθώς το ποσοστό 5ετούς επιβίωσης των ασθενών με μεταστατικό (Σταδίου IV) καρκίνο του πνεύμονα είναι 4%. Αξίζει να σημειωθεί δε, ότι το 85% των διαγνωσμένων περιστατικών αφορούν στο μη μικροκυτταρικό καρκίνο του πνεύμονα.
 Η απόφαση του FDA βασίστηκε στα αποτελέσματα της κλινικής μελέτης KEYNOTE-021 της MSD, που έδειξαν σημαντική υπεροχή του προαναφερόμενου συνδυασμού έναντι της χημειοθεραπείας στο ποσοστό ανταπόκρισης στη θεραπεία, αλλά και στην επιβίωση χωρίς εξέλιξη της νόσου.
Η απόφαση του FDA βασίστηκε στα αποτελέσματα της κλινικής μελέτης KEYNOTE-021 της MSD, που έδειξαν σημαντική υπεροχή του προαναφερόμενου συνδυασμού έναντι της χημειοθεραπείας στο ποσοστό ανταπόκρισης στη θεραπεία, αλλά και στην επιβίωση χωρίς εξέλιξη της νόσου.
Η ετυμηγορία του FDA για την κατά προτεραιότητα εξέταση του συνδυασμού ως θεραπεία πρώτης γραμμής για τον καρκίνο του πνεύμονα, αναμένεται στις 10 Μαΐου 2017.
To pembrolizumab είναι αυτή τη στιγμή εγκεκριμένο για τη θεραπεία του προχωρημένου (ανεγχείρητου ή μεταστατικού) μελανώματος και του προχωρημένου ή μεταστατικού καρκίνου του πνεύμονα, για ασθενείς που εκφράζουν PD-L1 κι έχουν λάβει ένα προηγούμενο σχήμα χημειοθεραπείας.




















Comments (0)