Ο Αμερικανικός Οργανισμός Τροφίμων και Φαρμάκων ενέκρινε το φάρμακο Talzenna (talazoparib) της Pfizer για την αντιμετώπιση ορισμένων ασθενών με προχωρημένο καρκίνο του μαστού.
Η νέα θεραπεία αφορά γυναίκες, στις οποίες ο όγκος έχει συγκεκριμένα γενετικά χαρακτηριστικά: θετικός σε μεταλλάξεις BRCA, αρνητικός κατά HER2 τοπικά προχωρημένος ή μεταστατικός.
Πολύ ενδιαφέρον είναι το γεγονός ότι, για να λάβουν τη θεραπεία, οι ασθενείς πρέπει να υποβάλλονται σε ειδική διαγνωστική εξέταση, που έχει απατυχθεί από την εταιρεία Myriad.
Η έγκριση βασίστηκε σε δεδομένα από τη μελέτη EMBRACA, στην οποία συμμετείχαν 431 ασθενείς, οι οποίες έλαβαν είτε talazoparib (1mg) είτε κάποια χημειοθεραπεία από το γιατρό ((capecitabine, eribulin, gemcitabine, ή vinorelbine). Τα αποτελέσματα έδειξαν ότι η επιβίωση χωρίς εξέλιξη της νόσου (PFS) ήταν 8,6 και 5,6 μήνες αντίστοιχα.
Οι συχνότερες (πάνω από το 20% των ασθενών) ανεπιθύμητες αντιδράσεις οποιουδήποτε βαθμού ήταν κόπωση, αναιμία, ναυτία, ουδετεροπενία, πονοκέφαλος, θρομβοπενία, έμετος, αλωπεκία, διάρροια και μειωμένη όρεξη.
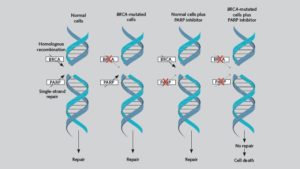 Το Talzenna (talazoparib) ανήκει σε μία νέα κατηγορία ογκολογικών φαρμάκων, που ονομάζονται αναστολείς PARP. Η PARP είναι μία πυρηνική πρωτεΐνη, η οποία είναι υπεύθυνη για την επισκευή βλαβών του DNA που επέρχονται φυσικά στα καρκινικά κύτταρα.
Το Talzenna (talazoparib) ανήκει σε μία νέα κατηγορία ογκολογικών φαρμάκων, που ονομάζονται αναστολείς PARP. Η PARP είναι μία πυρηνική πρωτεΐνη, η οποία είναι υπεύθυνη για την επισκευή βλαβών του DNA που επέρχονται φυσικά στα καρκινικά κύτταρα.
Οι αναστολείς του ενζύμου PARP ενδέχεται να εμποδίζουν την επισκευή αυτή, ενισχύοντας με αυτόν τον τρόπο την αποτελεσματικότητα της χημειοθεραπείας. Οι κύριοι αναστολείς του PARP είναι: olaparib, iniparib και veliparib.
Το φάρμακο αναπτύχθηκε από την εταιρεία BioMarin, η οποία πώλησε τα δικαιώματα στην Medivation το 2015, ενώ την επόμενη χρονιά περιήλθε στη Pfizer, η οποία εξαγόρασε την εταιρεία το 2016 έναντι 14 δισ δολαρίων.
Στην Ευρώπη, οι ευρωπαϊκές αρχές έχουν αποδεχθεί την αίτηση της Pfizer τον περασμένο Ιούνιο και η απόφαση αναμένεται τους επόμενους μήνες.



















Comments (0)